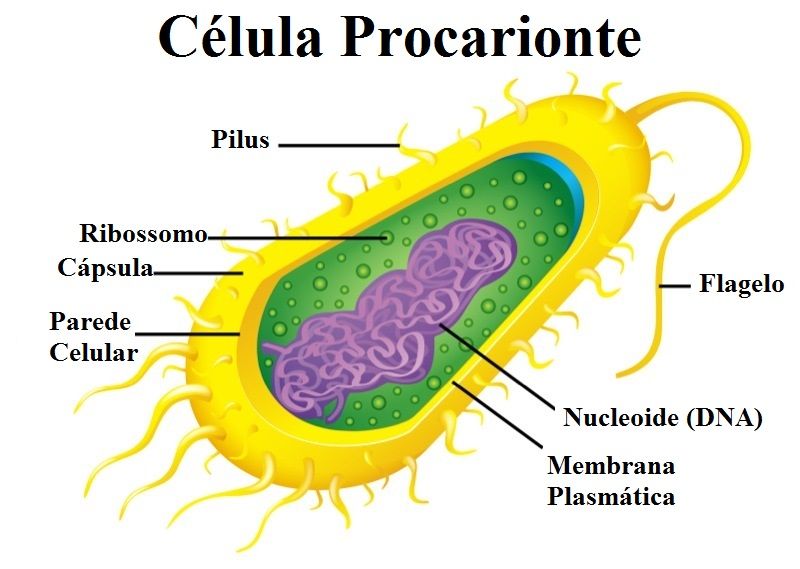
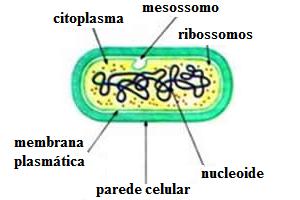
O mercantilismo e o surgimento do pré-capitalismo
Considera-se que a doutrina mercantilista vigorou entre o século XV e meados do século XVIII, resultado direto da expansão do comércio iniciada no final da idade média, com seu apogeu após o descobrimento da América e seu inexorável fluxo de metais preciosos.
Estávamos no canto do cisne do feudalismo, com o surgimento de um forte Estado Nacional, amparado por uma ascendente e “faminta” burguesia se contrapondo a este (feudalismo).
Enquanto aos monarcas, preponderantemente interessava o poder, a burguesia almejava o acúmulo de riquezas e apesar de ambos (poder e riqueza) estarem intimamente ligados, o primeiro só podia ser exercido com o apoio de exércitos bem armados, ou seja, sustentados de certa forma pelo segundo.
Por outro lado, a riqueza era mantida e ampliada com maior facilidade num ambiente em que leis e direitos fossem respeitados, sobretudo o direito de propriedade.
Acreditava-se na época, que uma nação seria tanto mais rica quanto maiores fossem sua população e seu estoque de metais preciosos. Esta é a resposta para a questão da origem da riqueza para os mercantilistas, assim, um país poderia se tornar mais rico se obtivesse um superávit comercial nas transações com seus parceiros, com o governo estimulando as exportações e dificultando ao máximo as importações.
Grosso modo, um pré-capitalismo, pois representou, acima de tudo, a transição para este modelo, sendo um sistema de intervenção estatal visando à prosperidade do Estado. Baseava-se no intervencionismo estatal e no protecionismo alfandegário. Embrião das Revoluções Industrial, Comercial e Imperialismo.
A política mercantilista estava voltada basicamente para três objetivos: o desenvolvimento de uma indústria ainda incipiente, o crescimento do comércio e a expansão do poderio naval. Assim, para incentivar o desenvolvimento industrial, o Estado concedia a grupos particulares o monopólio de determinados ramos de produção com o comércio sendo incentivado a crescer via criação de companhias comerciais como a Companhia das Índias Ocidentais e Orientais.
A expansão do poderio naval visava garantir a comunicação entre metrópole e colônia, para a realização de comércio entre as duas regiões.
TIPOS DE MERCANTILISMO
Os tipos mais importantes de mercantilismo foram: o bulionismo, o industrialismo, também chamado de colbertismo e o cameralismo, que seria em suma, a visão mercantilista dos alemães.
O bulionismo (também conhecido como metalismo) desenvolveu-se primordialmente na Espanha, para onde fluía o ouro do México e a prata do Peru. Portugal também implantou a política bulionista, na exploração de suas colônias, de onde explorava ouro, essencialmente o ouro brasileiro.
Este tipo de mercantilismo tem como traço marcante o desinteresse pelos processos de industrialização, assim, necessitando cada vez mais importar, gerando um aumento no gasto com pagamentos destes bens (muitas vezes supérfluos), ocasionando elevação na taxa de inflação, hoje lição aprendida, aumento do meio circulante conjugada com aumento da demanda e oferta limitada.
O comercialismo originou-se na Inglaterra, um viés do bulionismo, pois já que a Inglaterra não possuía colônias pródigas em metais preciosos, encontrou outra forma de acumulação, desta forma, seu desenvolvimento manufatureiro e poderio naval impulsionaram, sobretudo no século XVII, a expansão do seu comércio exterior.
Os navios da marinha mercante distribuíam no mercado mundial os tecidos produzidos pelas manufaturas inglesas, possibilitando ao país o acúmulo de metais preciosos através da manutenção de uma balança comercial favorável.
Segundo os ingleses: ‘‘A única maneira de fazer com que muito ouro seja trazido de outros remos para o tesouro real é conseguir que grande quantidade de nossos produtos seja levada além dos mares, e menor quantidade de seus produtos seja para cá transportada…”.
Foram pedras fundamentais no mercantilismo inglês, tanto Thomas Mun (1571-1641), como John Locke (1632-1704). Enquanto para o primeiro, a resposta ao caminho da riqueza estava no excedente de exportação, assim aumentando o acúmulo de ouro e prata, o segundo, Locke, possui idéias avançadas sobre o dinheiro, (já) questionando a velocidade de sua circulação, ao argumentar que o valor do dinheiro com relação aos outros artigos depende exclusivamente da fatura ou escassez do dinheiro proporcionalmente a fatura ou a escassez desses artigos, não dependendo da quantidade desses bens, mas da velocidade de sua circulação e que o saldo comercial adverso, poderia conduzir uma nação à ruína.
O industrialismo teve seu apogeu na França, com Colbert, na época ministro de Luís XIV. Colbert vai buscar gerar uma balança comercial favorável na França através da proibição das importações e do incentivo às exportações. O que gerará a necessidade de tornar a França auto-suficiente, investindo nas manufaturas nacionais.
Jean Baptiste Colbert (1619-1683) representa a alma do mercantilismo francês, denominado colbertismo. Defendia a acumulação de metais preciosos e que a coleta e impostos e um estado forte, incentivaria a exportação com redução de importação, com leis impedindo a saída de metais preciosos do país. As colônias eram importantes como mercado consumidor e fornecedor de matéria prima, defendia uma grande marinha mercante, o expansionismo de um país em detrimento do outro, enfim, um estado absoluto, controlando e regulando toda a produção.
O cameralismo, como dito em parágrafo anterior, é a versão mercantilista dos alemães. Foram industrialistas, protecionistas e nacionalistas, orientava-se uma política de tributação, leis, técnicas na produção, venda e distribuição, visando o aumento do poder do estado com centralização deste (poder).
A produção era apenas em função do estado, inibindo desta forma a iniciativa privada e sua “criatividade” (causaria arrepios em Schumpeter, se este já tivesse nascido).
Podemos citar Ludwig von Seckendorff (1626-1692), com sua defesa de que os excedentes de produção devem ser trocados por produtos úteis e necessários, para tanto elaborando uma ordem reguladora dos preços das mercadorias mais necessárias. Por curiosidade, coloco que ele defendia a “suspensão de ocupações parasitárias”. O que no entender de Seckendorff, seria parasitário? Prenúncio de um totalitarismo?
CONCLUSÃO
A principal conseqüência (e objetivo) da política mercantilista européia é o processo de acumulação primitiva do capital, realizado principalmente através do acúmulo dos metais preciosos retirados das colônias.
Para o Velho Mundo foram drenados os metais preciosos da América espanhola, o açúcar e o ouro do Brasil, os produtos tropicais da África e da América e as especiarias do Oriente.
A acumulação de capital foi, assim, duplamente primitiva: por ter sido a primeira grande acumulação de riqueza realizada por um continente em toda a história da humanidade, e pelos métodos brutais empregados pelos europeus para realizá-la.
O poderio naval e o desenvolvimento manufatureiro fizeram da Inglaterra o país que maiores lucros obteve na Revolução Comercial e que mais ouro e prata acumulou com o mercantilismo. Esses capitais acumulados fizeram da Inglaterra a fábrica do mundo e lhe conferiram um papel pioneiro na Revolução Industrial.
Com o processo de industrialização, sobreveio a crise do mercantilismo com outros países percebendo suas limitações e adotaram o comércio livre (ou pelo menos um pouco mais livre) a partir da década de 1860.
Esta liberdade de comércio (laissez-faire, laissez-passer, ou seja, a mais ampla liberdade de comércio e de produção), se estenderia finalmente à liberdade de “comercializar dinheiro”, com o início da haute finance, designação do economista Karl Polanyi para o grande capital financeiro internacional, que começa a se organizar em meados do século XIX, no primeiro grande ciclo de liberalização financeira.
Fonte: Se 1 ler tá bom
ESTUDANDO PARA O IFES? VEJA TAMBÉM!
Reforma, Contrarreforma e Renascimento Cultural
O Absolutismo dos reis e o Estado Moderno;
IFES – Conteúdo programático 2019




 O número de massa e o número atômico
O número de massa e o número atômico
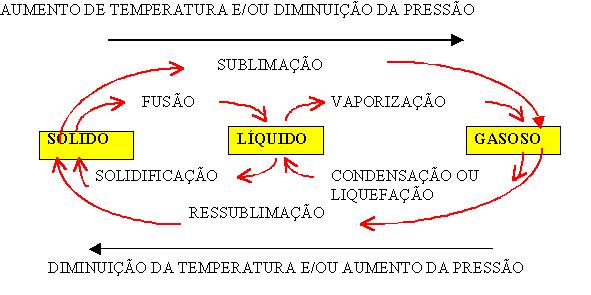


.jpg) Estado Gasoso: a movimentação das moléculas nesse estado é bem maior que no estado líquido ou sólido. Se variarmos a pressão exercida sobre um gás podemos aumentar ou diminuir o volume dele, sendo assim, pode-se dizer que sofre compressão e expansão facilmente. Os elementos gasosos tomam a forma do recipiente que os contém.
Estado Gasoso: a movimentação das moléculas nesse estado é bem maior que no estado líquido ou sólido. Se variarmos a pressão exercida sobre um gás podemos aumentar ou diminuir o volume dele, sendo assim, pode-se dizer que sofre compressão e expansão facilmente. Os elementos gasosos tomam a forma do recipiente que os contém.
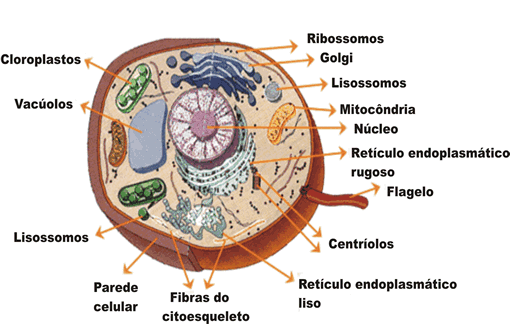 Já as células eucarióticas, possuem maior tamanho e complexidade, a começar pelo núcleo individualizado, envolvido pela carioteca. Seu citoplasma é interconectado por uma rede de tubos e canais membranosos e é onde, além de ribossomos, também são encontradas mitocôndrias, retículo endoplasmático granuloso e não granuloso, complexo golgiense, lisossomos, peroxissomos, centríolos, dentre outras organelas.
Já as células eucarióticas, possuem maior tamanho e complexidade, a começar pelo núcleo individualizado, envolvido pela carioteca. Seu citoplasma é interconectado por uma rede de tubos e canais membranosos e é onde, além de ribossomos, também são encontradas mitocôndrias, retículo endoplasmático granuloso e não granuloso, complexo golgiense, lisossomos, peroxissomos, centríolos, dentre outras organelas.