COMBO CARREIRA BANCÁRIA COM 9 APOSTILAS POR APENAS R$ 28,90 CLIQUE AQUI!!
No final da postagem tem várias videoaulas para você assistir.
Dica: Estou atualizando o Conteúdo Programático completo do ENEM e além disso, para você que não esta encontrando todo o conteúdo do Enem ou prefere estudar por apostilas dá uma olhada nesta apostilas para ENEM do site Apostilas Opção é bem interessante.
Bons estudos!
Átomos: Semelhanças atômicas, distribuição eletrônica e modelos atômicos.
Semelhanças atômicas:
Se analisarmos o número atômico (Z), o número de nêutrons (N) e o número de massa (A) de átomos diferentes, será possível identificar e formar conjuntos de átomos com algumas similaridades. Esta propriedade dos átomos recebe o nome de semelhança atômica.

Isótopos: átomos pertencentes a um mesmo elemento químico, portanto possuem números atômicos iguais. Os isótopos se diferenciam com relação ao número de massa, acompanhe os exemplos:
O elemento químico Magnésio (Mg) possui os seguintes isótopos:
12Mg24 (presente na natureza com a porcentagem de 78,9%)
12Mg25 (presente na natureza com a porcentagem de 10,0%)
12Mg26 (presente na natureza com a porcentagem de 11,1%)
Os isótopos de hidrogênio recebem nomenclatura própria, veja:
1H1 – Hidrogênio comum, prótio, hidrogênio leve;
1H2 – Deutério;
1H3 – Trítio, tritério, tricério.
O hidrogênio comum é o que encontramos em maior quantidade na natureza, está presente na proporção de 99,9% em relação a seus isótopos.
Isóbaros: esses átomos possuem o mesmo número de massa (A), mas se diferem na numeração atômica (Z), os elementos Cálcio (Ca) e Argônio (Ar) são isóbaros.
18Ar40 20Ca40
Como os isóbaros acima não pertencem a elementos químicos iguais, suas propriedades químicas se diferenciam.
Isótonos: átomos com número de nêutrons (n) iguais que se diferem pelo número atômico (Z) e de massa (A). Magnésio (Mg) e Silício (Si) são exemplos de Isótonos.
12Mg26 14Si28
P = 12 n = 14 P = 14 n = 14
Estes isótonos pertencem a diferentes elementos químicos, o que nos leva a concluir que possuem diferentes propriedades químicas e físicas.
Um macete para não esquecer:
IsótoNos – mesmo número de nêutrons.
IsótoPos – mesmo número de prótons.
IsóbAros – mesmo número de massa.
Isoeletrônicos
Átomos neutros apresentam o mesmo número de prótons e elétrons, porém, esses átomos podem ganhar ou perder elétrons, passando a formar íons. Os átomos e íons que apresentam o mesmo número de elétrons são denominados isoeletrônicos. Exemplos:
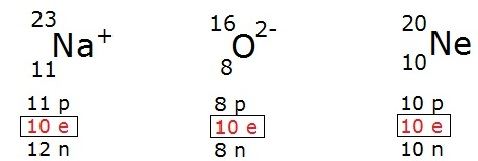
Fontes: Mundo Educação, Info escola e Brasil escola
Distribuição eletrônica
Linus Carl Pauling (Portland, 28 de Fevereiro de 1901 — Big Sur, 19 de Agosto de 1994) foi um químico quântico e bioquímico dos Estados Unidos. Pauling é amplamente reconhecido como um dos principais químicos do século XX. Foi pioneiro na aplicação da Mecânica Quântica em química e, em 1954, foi galardoado com o Nobel de Química pelo seu trabalho relativo à natureza dasligações químicas. Também efetuou importantes contribuições relativas à determinação da estrutura de proteínas e cristais, sendo considerado um dos fundadores da Biologia Molecular.Pauling recebeu o Nobel da Paz de 1962, pela sua campanha contra os testes nucleares e é a única personalidade a ter recebido dois Prémios Nobel não compartilhados. As outras personalidades que receberam dois Prémios Nobel foram Marie Curie (Física e Química), John Bardeen (ambos em Física) eFrederick Sanger (ambos em Química). Pauling popularizou as suas ideias, análises, pesquisa e visões em vários livros de sucesso, mas controversos, sobre a temática da vitamina C e Medicina Ortomolecular.
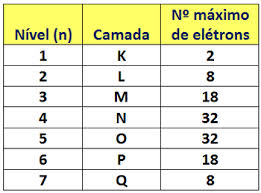
Nos elementos químicos conhecidos, os átomos podem distribuir-se em 7 níveis de energia (contendo elétrons) que são representados, em sequência, a partir do núcleo, pelas letras K, L, M, N, O, P, Q ou pelos números 1, 2, 3, 4, 5, 6, 7. Estes números são chamados de números quânticos principais, eles representam a aproximada distância do elétron ao núcleo, como também a energia do elétron. Se um elétron tem número quântico principal igual a 3, ele pertence à camada M e tem a energia desse nível.
Exemplo:
Represente, esquematicamente, o átomo de número atômico 17 e número de massa 35.
Temos: Nº de prótons: Z = 17
Z = 17 Nº de elétrons: Z = 17
A = 35 Nº de nêutrons N = A – Z = 35 – 17 = 18
Distribuição eletrônica:
COMBO CNU - 2024 COM 8 APOSTILAS POR APENAS R$ 29,90 - SAIA NA FRENTE!!
Camada de valência
O nível de energia mais externa do átomo é denominado camada de valência. Assim, no átomo do exemplo anterior é a camada M. Ela pode conter, no máximo, 8 elétrons.
Subníveis de energia
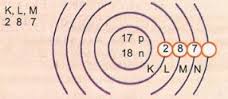
Verificou-se que a radiação correspondente à energia liberada, quando um elétron passa de um nível de energia mais afastado para outro mais próximo do núcleo, é, na realidade, a composição de várias ondas luminosas mais simples. Conclui-se, então, que o elétron percorre o caminho “aos pulinhos’, isto é, os níveis de energia subdividem-se em subníveis de energia”.
Nos átomos dos elementos conhecidos, podem ocorrer 4 tipos de subníveis, designados sucessivamente pelas letras s (“sharp”), p (“principal”), d (“diffuse”) e f (“fundamental”).
O número máximo de elétrons distribuído em cada subnível é:
| s | p | d | f |
| 2 | 6 | 10 | 14 |
Notação da configuração eletrônica
Escreve-se o número quântico principal antes da letra indicativa do subnível, a qual possui um “expoente” que indica o número de elétrons contidos nesse subnível.
Exemplo: 3p5
Significado: Na camada M (número quântico principal = 3), existe o subnível p, contendo 5 elétrons.
Para se dar a configuração eletrônica de um átomo, colocam-se os elétrons, primeiramente, nos subníveis de menor energia (estado fundamental).
Exemplo: Na (Z = 11)
Na: 1s2 2s2 2p6 3S1
Deve-se observar a ordem energética dos subníveis de energia, que infelizmente não é igual à ordem geométrica. Isso porque subníveis de níveis superiores podem ter menor energia total do que subníveis inferiores.
Resumindo:
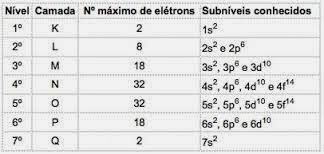
Método gráfico para ordenação dos subníveis
Descendo as diagonais, a energia vai aumentando (Diagrama de Linus Pauling).
Ordem energética dos subníveis:
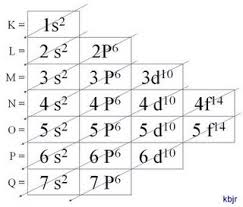
1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s – 4d – 5p – 6s – 4f – 5d – 6p – 7s – 5f – 6d – 7p
Exemplo de distribuição eletrônica:
Átomo de ferro (Z=26).
Solução:
Escrevendo na ordem de preenchimento (energética), temos:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Escrevendo na ordem de camada (geométrica):
K: 1s2
L: 2s2 2p6
M: 3s2 3p6 3d6
N: 4s2
| K | L | M | N |
| 2 | 8 | 13 | 2 |
Fonte: Naturais Química
Modelos Atômicos
Modelos Atômicos de Dalton, Thomson, Rutherford, Rutherford-Bohr.
Fiz uma postagem bem completa sobre este assunto com várias videoaulas.
Natureza elétrica da matéria: Modelo Atômico de Dalton, Thomson, Rutherford, Rutherford-Bohr.

-
Átomo: estrutura atômica,
-
Átomo: número atômico e número de massa
-
Enem conteúdo programático 2017
-
Ifes conteúdo programático 2017
COMBO INSS COM 8 APOSTILAS POR APENAS R$ 26,90 COMECE A SE PREPARAR!!!


